Hogyan állapítható meg, a vegyérték 2
Definíciója szerint az iskolai vegyérték - kémiai elem az a képesség, hogy egy adott számú kémiai kötést létesíteni más atomokkai.
Amint az jól ismert, vegyérték állandó (ha kémiai elem mindig képezik az azonos számú kötést létesíteni más atomokkai) és variábilis (attól függően, hogy amikor egy anyagot vegyértéke ugyanazon cella változik).
Határozza meg a vegyérték segíteni periódusos rendszer a kémiai elemek D. I. Mendeleeva.
A következő szabályokat alkalmazza:
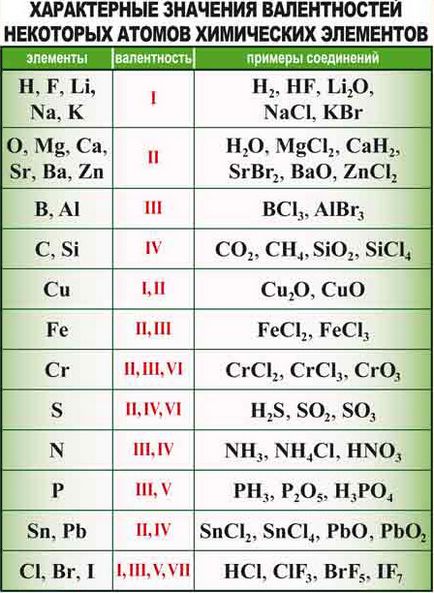
1) A maximális vegyértéke egy kémiai elem megegyezik a csoport száma. Például, a klór egy 7-edik csoport, és ezért a maximális vegyértéke 7. Sera: ez a 6. csoport, azt jelenti, hogy ez egyenlő a maximális vegyértékű 6.
2) Minimális vegyértéke azonos 8 mínusz nemfémek csoport számát. Például, a minimális az azonos vegyérték klór 8 - 7, azaz 1.
Sajnos, mind a szabályok, vannak kivételek.
Például, a réz az 1. csoport, de a maximális vegyértékű réz nem 1, a 2.
Az oxigén a 6. csoportban, de ez szinte mindig vegyértékű 2, nem 6.
További hasznos megjegyezni a következő szabályokat:
3) Az összes alkálifém (I. csoport, a fő alcsoport) mindig van egy vegyértéke 1. Például, a nátrium-vegyértéke mindig egyenlő 1, mert ez egy alkálifém.
4) Az összes alkáliföldfém (II csoport, tagjainak fő csoport), mindig van egy vegyértéke 2 Például, a magnézium mindig egyenlő a vegyértékének 2, mivel ez alkáliföldfém.
5) Az alumínium mindig vegyértékű három.
6) Hidrogén mindig van egy vegyértéke az 1.
7) Az oxigén szinte mindig van egy vegyértéke 2.
8) Szén szinte mindig van egy vegyértéke 4.
Tartsuk szem előtt, hogy a különböző forrásokból meghatározza a vegyérték változhat.
Többé-kevésbé pontos vegyértékét definiáljuk, mint a számát elektron párok közös ami által a hatóanyag atom kapcsolódik a többiekkel.
E meghatározás szerint, leköti a nitrogén a HNO3 egyenlő 4, ahelyett 5. ötértékű nitrogént nem lehet, mert ebben az esetben a nitrogénatommal mintegy 10 bekarikázott elektronokat. De ez nem lehet, mert az elektronok maximális 8.
Kémiai elemek lehet állandó vagy változó vegyértékű. Elements állandó vegyérték kell tanulni. mindig
- egyértékű hidrogén, halogének, alkálifémek
- kétértékű oxigén, alkáli-földfémek.
- háromértékű alumínium (Al) és a bór (B).
Valence lehet meghatározni periódusos. Magasabb vegyértéke egy elem mindig megegyezik a szám a csoport, amelyben ez található.
Alsó változó vegyérték gyakran nem-fémek. Ahhoz, hogy megtalálja az alacsonyabb vegyérték sáv levonjuk a 8-as szám - az eredmény az lesz az ismeretlen mennyiség. Például, a kén egy 6-csoport, és a legmagasabb vegyérték - VI, egy alacsonyabb vegyérték II (8-6 = 2).
Határozza meg a vegyérték a periódusos rendszer egyszerű. Általában ez felel meg a csoport számát, amelyben az elem található. De vannak elemek, amelyek a különböző vegyületek különböző vegyértéke. Ebben az esetben beszélünk fix és változó vegyértékű. Változó lehet egy legfeljebb egyenlő a csoport szám, és lehet a minimum vagy közepes.
De ennél sokkal érdekesebb, hogy meghatározza a vegyérték vegyületekben. Ehhez számos szabályt. Először vegyérték könnyen meghatározhatja az egyik elem az elemek a vegyület konstans vegyérték például oxigén- vagy hidrogénatom. Balról, hogy a redukálószer, azaz egy elem pozitív vegyértékű jobb - oxidálószer, ez egy elem egy negatív irányban. Az index a konstans vegyérték szorozva a vegyérték, és van osztva az index egy ismeretlen vegyértéke.
Példa: Szilícium-oxidok. oxigén vegyérték -2. Találunk szilícium vegyérték.
SiO 1 * 2/1 = 2 Valence szilícium-monoxid egyenlő kettő.
SiO2 2 * 2/1 = 4 A vegyértéke szilícium-dioxid megegyezik a négy.
Az elem lehet egy vagy több vegyértékkel.
A maximális vegyértéke elemek számával megegyező a vegyérték elektronok. Tudjuk meg a vegyérték, ismerve a helyét az elem a periódusos rendszerben. A maximális szám vegyértékével egyenlő a csoport számának, amely szükséges elem.
Vegyérték által kijelölt római számokkal és általában írva a jobb felső sarokban az elem szimbólum.
Egyes elemek lehetnek különböző vegyértékű különböző vegyületek.
Például, a kén vegyértéke a következő:
- A II vegyület H2S
- SO2 a vegyületet IV
- A vegyületet VI SO3
A szabályok meghatározására vegyérték nem olyan egyszerű használni, poetomuih emlékezni.
Vegyértéke egy elem lehet meghatározni a periódusos rendszer, a csoport száma.
Legalábbis, ez lehet tenni a fémek esetében, mert a számuk egyenlő a vegyérték sáv.
A nem-fémek némileg eltérő történet: a magasabb vegyértékű (vegyületekben oxigénnel) is egyenlő a szám a csoportban, de alacsonyabb vegyérték (a vegyületeket hidrogénnel és fémek) kell meghatározni a következő képlet: „8 - száma a csoportban.”
Minél többet dolgozni kémiai elemek, annál jobban emlékeznek, és vegyérték. És kezdeni elég ilyen „puskát”:
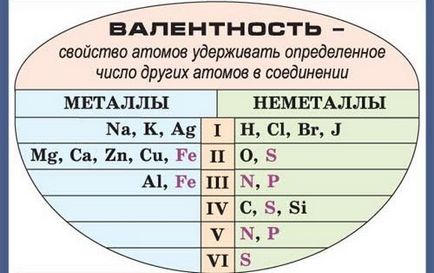
Pink szín jelzi azokat az elemeket, amelyek vegyértékű változó.
Az első és legfontosabb, érdemes megjegyezni, hogy a kémiai elemek lehetnek állandó vagy változó vegyértékű. Mivel az állandó vegyérték, ezek az elemek csak egyszerűen kell megjegyeznünk
Monovalens alkálifémek tartják, hidrogén-, vagy halogénatom;
A feltételezett kétértékű alkáliföldfémek, valamint az oxigén;
De trohvalenten bór és az alumínium.
Tehát most menjünk át a periódusos rendszer határozza meg a vegyérték. A legmagasabb vegyérték egy elem mindig megegyezik a számát a csoport
Alacsonyabb vegyérték felismerhető kivonva 8 csoport számát. Alacsonyabb vegyérték felruházva nemfémek nagyobb mértékben.
Valetnost- atomok az a képesség, az egyes kémiai elemek hozzáragad atomok más elemek. A sikeres írás képletek, a helyes megoldást a problémákra kell ismernie. hogyan kell meghatározni a vegyérték. Először meg kell tanulni az összes eleme állandó vegyérték. Itt vannak: 1. hidrogénatom, alkálifém (egyértékű mindig); 2. Az oxigén és alkáliföldfém (kétértékű); 3. B és Al (trivalens). Annak megállapításához, a vegyérték a periódusos rendszer. Meg kell tudnunk, hogy mi a csoport áll a kémiai elem, és meghatározza azt a fő csoport vagy az oldalán.
Vegyértéke bármely kémiai elem - az a tulajdonság, hanem inkább a tulajdonsága annak atomok (atomok ezen elem), hogy tartsa a - az atomok számát, hanem egy eltérő kémiai - edik eleme.
Ott Chem - UE elemeket, mint egy állandó és egy változó vegyérték, amely változik attól függően, hogy a kapcsolat minden eleme egy (aktív elem) van, vagy jön.
Vegyértéke egyes kémiai elemek:
Most viszont, hogy hogyan ugyanaz határozza meg a vegyérték az elem táblázatban.
Így, a vegyérték lehet meghatározni a periódusos:
- Magasabb vegyértékű párosított ellen (egyenlő) a szám a csoport;
- az alsó vegyértéke ugyanazon adja a csoport szám - 8.
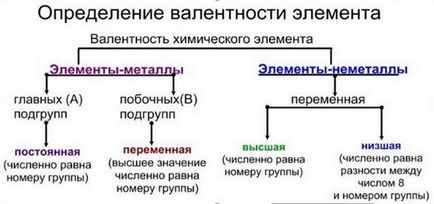

Az iskola természetesen kémia, tudjuk, hogy minden kémiai elem lehet állandó vagy változó vegyértékű. Elemek, amelyek állandó vegyértékű kell egyszerűen emlékezni (például hidrogén, oxigén, alkáli fémek és egyéb elemek). Valcncy könnyen azonosítható a periódusos rendszer, amely bármely tankönyv kémia. Magasabb értékű, ami megfelel a csoport száma, amelyben található.
Annak érdekében, hogy meghatározzák a vegyérték egy anyag, meg kell nézni a periódusos kémiai elemek által kijelölt római számokkal lesz valenciák bizonyos anyagok a táblázatban. Például, DK, hidrogénatom (H) mindig egy vegyértékű és, mint az oxigén (O) mindig két vegyértékű. Íme egy bizonyos szint alá gyermekágy, ami azt hiszem segít)