A szerkezet a polipeptid-lánc, és a peptid-kötés
aminosav-monomerek, amelyek egy részét a polipeptidek, aminosavak említett. Aminosavmaradék, amelynek egy szabad aminocsoportot, az úgynevezett N-terminális és a baloldalon a peptid-lánc, és amelynek szabad α-karbo-ksilnuyu csoport - a C-terminális, és feljegyezzük a jobb oldalon. A tartomány ezen áramkör megismétli atomok-CH - CO - NH- a láncban polipetidnoy nevezett peptidváz.
A polipeptid-lánc a következő általános formája:

ahol R1. R2. R3. ... Rn - aminosav-gyökök alkotó oldallánc.
A megnyilvánulása a biológiai funkciók peptidek és fehérjék fontos szerepet játszik az elektronikus és térbeli szerkezetét a peptid-csoport:
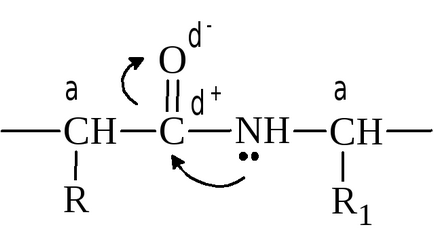
A jelenléte p-π-konjugációs csoportot a peptid vezet részleges dvoesvyazannosti kötést - N. peptidkötés hossza C - N egyenlő 0,132 nm és kötéshossz N - Sα van 0,147 nm. Egyszeres kötés C - N, a peptidek körülbelül 40% van a természet a kettős kötés, és a kettős kötés a C = O körülbelül 40% az egységes. Ez a tény két fontos következménye van:
1) iminocsoport (- NH -) peptidkötés nincs Határozottan kifejezett képessége hasítják, illetve csatolja a proton;
2) szabad rotáció körül a c kötés - N elérhető.
Részleges dvoesvyazannost a C - N azt jelenti, hogy a peptid gyököt egy lapos része a peptid láncban. Peptid csoportokat síkban elhelyezett szögben egymáshoz:

Körül a C - Sα és N - Sα lehetséges forgás, bár méretük korlátozott, és a természet a gyökök, amely lehetővé teszi a polipeptid lánc, hogy a különböző konfigurációkban.
A peptid-kötés egy egyszeres kovalens kötés, amelynek segítségével az aminosav-oldalláncok kapcsolódnak egymáshoz, vázát alkotó a fehérjemolekula.
A peptid kötések általában található egy transz-konfigurációban, azaz a α-szénatom található mindkét oldalán a peptid kötést. Ennek eredményeként, oldalsó csoportok aminosavak a térben a legtávolabb egymástól.
Homenklatura peptidek
Amikor a polipeptid címet a neve valamennyi aminosav, kivéve az utolsót, adjuk hozzá a utótag -il. terminális aminosav végződik -in. Például, a peptid Met-Asp-Val-Pro a teljes neve metionil aszpartil öntött prolin.
A sav-bázis tulajdonságaiban az peptidek
Sok rövid peptidek kapunk tiszta kristály-kristály-forma. A magas hőmérséklet az olvadáspont, hogy a semleges oldatok peptidek kristályosodni, mint bipoláris ionok. Mivel egyik α-karboxil-csoportok, és egyik sem a α-amino-csoportok vesznek részt a peptidkötések kialakításának, nem ionizáltak a pH-tartományban 0-14, a sav-bázis tulajdonságaiban az peptidek határozza meg a szabad NH2 csoport N-terminális maradék, és egy szabad karboxilcsoportot C-terminális maradék a peptid és az R-csoportok, amelyek képesek az ionizáció. A szám a hosszú peptid láncok ionizált R-csoportok rendszerint nagy, mint a két végcsoportok ionizált peptid maradék. Ezért, jellemzésére sav-bázis tulajdonságai peptidek, figyelembe vesszük a rövid peptidek.
A szabad α-amino- és szabad terminális karboxilcsoportot a peptidek távolság választja el egymástól szignifikánsan nagyobb, mint az egyszerű aminosavak, és így, az elektrosztatikus inter-akció közöttük gyengült. PK értékeket a karboxil végcsoportot az peptidek valamivel magasabb, és a terminális α-amino-csoport valamivel alacsonyabb, mint a megfelelő szabad aminosavak. Az R-csoportok nem különböztek szignifikánsan a rövid peptidek és a szabad aminosavak a megfelelő pK.
Ahhoz, hogy határozza meg a pH-tartomány, amelyben az izoelektromos pont lehet egy rövid peptid a vizsgálat, elegendő összehasonlítani a száma a szabad aminocsoportok száma és a szabad karboxil-csoportok, többek között az N- és C-terminális csoportok. Ha a szám a amincsoportok meghaladja a karboxilcsoportok száma izoelektri Env peptid pont fog feküdni a lúgos pH-tartományban, hogy megakadályozza a protonálódása aminocsoportok szükséges lúg. Ha a karboxilcsoportok száma meghaladja a aminocsoportok száma, az izoelektromos pont lesz a savas pH-tartományban, mivel a savas környezet gátolja a disszociációs karboxilcsoportok.